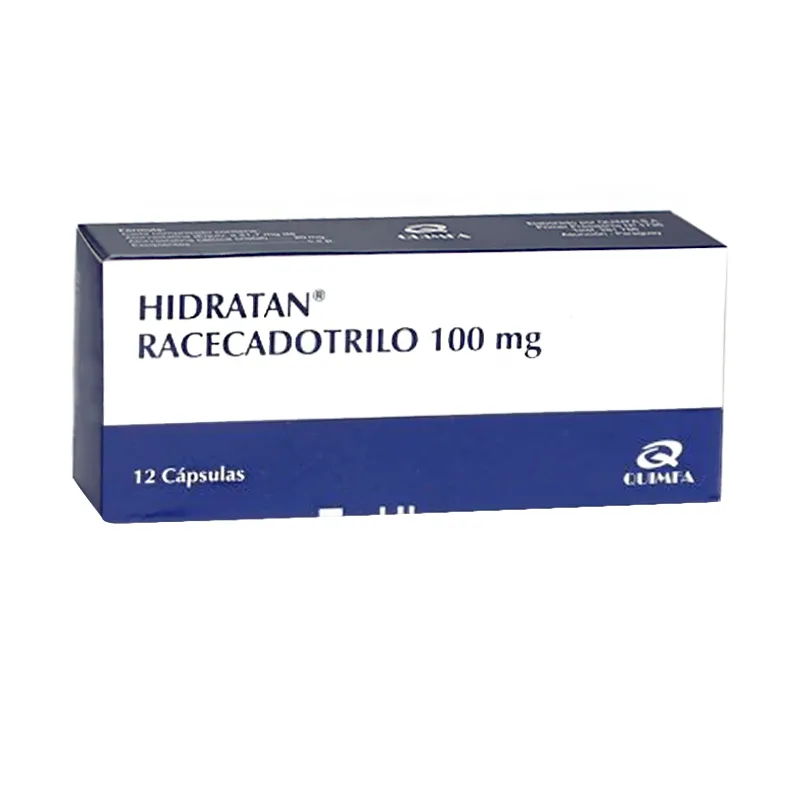
Hidratan Racecadotrilo 100 mg - Caja de 12 Cápsulas
(0
Comentarios)
Producto interno
Precio
₲72.410
/uni
Reembolso
No aplicable
Compartir
Productos más vendidos
Reseñas y calificaciones
0
de 5.0
(0
Comentarios)
Todavía no ha habido reseñas para este producto.
Grupo farmacoterapéutico: Otros antidiarreicos Código A.T.C.: A07XA04 Racecadotrilo es un fármaco que necesita hidrolizarse a su metabolito activo Tiorfan, el cual es un inhibidor de la encefalinasa, peptidasa de la membrana celular situada en varios tejidos, de forma notable en el epitelio del intestino delgado. Esta enzima contribuye tanto a la hidrólisis de los péptidos exógenos como a la rotura de los péptidos endógenos tales como las encefalinas. El Racecadotrilo protege las encefalinas de la degradación enzimática, prolongando su acción en las sinapsis encefalinérgicas del intestino delgado y reduciendo la hipersecreción. El Racecadotrilo es un antisecretor intestinal puro. Disminuye la hipersecreción intestinal de agua y electrolitos inducida por la toxina del cólera o la inflamación y no tiene efectos sobre la secreción basal. El Racecadotrilo ejerce una actividad antidiarreica rápida sin modificar el tiempo del tránsito intestinal. El Racecadotrilo no provoca distensión abdominal. Cuando se administra por vía oral, su actividad es exclusivamente periférica, sin efectos sobre el sistema nervioso central. La cápsula de 100 mg de Racecadotrilo a dosis terapéuticas (1 cápsula) o en dosis supraterapéutica (4 cápsulas) no induce prolongación del intervalo QT/QTc.
Por vía oral, el Racecadotrilo se absorbe rápidamente.
La exposición en situación de equilibrio es comparable con la exposición después de una sola dosis.
La biodisponibilidad del Racecadotrilo no se modifica por la alimentación pero el pico de la actividad se retrasa aproximadamente una hora y media.
Distribución:
Tras la administración oral de Racecadotrilo marcado con C14, la concentración de Racecadotrilo es 200 veces más alta en plasma que en las células de la sangre y 3 veces superior en plasma que en sangre total. Así, el fármaco no se une a células de la sangre de manera significativa. La distribución de radiocarbono en otros tejidos del cuerpo es moderada, tal como se indica por el volumen aparente de distribución en el plasma de 66.4 kg. El 90% del metabolito activo del Racecadotrilo, la (RS)-N-(1-oxo-2-(mercaptometil)-3-fenilpropil)glicina, se une a las proteínas plasmáticas, principalmente a la albúmina. Las propiedades farmacocinéticas del Racecadotrilo no se modifican con la administración repetida o con la administración en personas de edad avanzada.
La duración y la magnitud del efecto del Racecadotrilo es dosis-dependiente. El pico de actividad inhibidora sobre la encefalinasa plasmática se observa aproximadamente 2 horas después de la administración y corresponde a una inhibición del 90% con la dosis de 100 mg.
La duración de la actividad inhibidora sobre la encefalinasa plasmática es de aproximadamente 8 horas con una dosis de 100 mg.
Metabolismo:
La vida media del Racecadotrilo, valorada como inhibición de la encefalinasa plasmática, es de aproximadamente 3 horas.
El Racecadotrilo se hidroliza rápidamente a (RS)-N-(1-oxo-2-(mercaptometil)-3-fenilpropil)glicina, el metabolito activo, que a su vez se transforma en metabolitos inactivos identificados como sulfóxido de S-metil tiorfano, S-metil tiorfano, ácido 2-(benciltiometil) propiónico y ácido 3-fenilpropiónico, y otros metabolitos formados a más del 10% de la exposición sistémica del fármaco precursor.
Otros metabolitos menores también fueron detectados y cuantificados en orina y heces.
La administración repetida de Racecadotrilo no provoca acumulación en el cuerpo.
Racecadotrilo/tiorfano y los cuatro metabolitos inactivos principales no inhiben las isoformas del citocromo CYP, principales 3A4, 2D6, 2C9, 1A2 y 2C19 en una medida que pudiera ser clínicamente relevante.
Racecadotrilo/tiorfano y los cuatro metabolitos inactivos principales no inducen las isoformas de las enzimas CYP, principales 3A4, 2B6, 2C9, 2A6, 1A2, 2E1 y enzimas UGTs conjugadas en una medida que pudiera ser clínicamente relevante.
El Racecadotrilo no modifica la unión a proteínas de los fármacos fuertemente unidos a las mismas, tales como la Tolbutamida, Warfarina, Ácido Niflúmico, Digoxina o Fenitoína.
En pacientes con insuficiencia hepática (cirrosis, grado B de la clasificación Child-Pugh), el perfil cinético del metabolito activo del Racecadotrilo presenta una Tmax y una Cmax similar y una Cmin (65%) y una AUC (29%) menores, en comparación con pacientes sanos.
En pacientes con insuficiencia renal grave (aclaramiento de creatinina $11-39 \text{ mL/min}$), el perfil cinético del metabolito activo del Racecadotrilo presenta una Cmax inferior (-49%) y una AUC (+16%) y una T$1/2$ superior, comparando con pacientes no-IR (aclaramiento de creatinina $>70 \text{ mL/min}$).
Tanto en la población pediátrica como en población adulta la farmacocinética es similar, alcanzando una Cmax a las 2 horas $30 \text{ min}$ después de la administración. No hay acumulación después de dosis múltiples administradas cada 8 horas, durante 7 días.
Excreción:
El Racecadotrilo se elimina en forma de metabolitos activos e inactivos. La principal vía de eliminación es la renal (81,4%) y, en mucho menor grado, la fecal (alrededor de un 8%). La eliminación por vía pulmonar no es significativa (inferior al 1% de la dosis).
Tratamiento sintomático de la diarrea aguda inespecífica en adultos.
Hipersensibilidad al principio activo.
Adultos:La dosis inicial es de $100 \text{ mg}$ (1 cápsula), cualquiera que sea la hora del día. Posteriormente, $100 \text{ mg}$ (1 cápsula) tres veces al día preferiblemente antes de las comidas principales.2El tratamiento debe continuar hasta que se produzcan 2 deposiciones normales. El tratamiento no debe prolongarse más de 48 horas.3El tratamiento será complementario a las medidas dietéticas.4Población pediátri5caNo debe ser utilizado en niños y adolescentes.Personas de edad avanzada:No es necesario el ajuste de dosis en personas de edad avanzada (ver Propiedades Farmacocinéticas).Insuficiencia renal y/o hepática:Se recomienda precaución en pacientes con insuficiencia hepática o renal (ver Propiedades Farmacocinéticas).
Precauciones de empleo: La administración de racecadotrilo no modifica las pautas habituales de rehidratación. Si no se observa mejoría clínica en 48 horas o si aparece fiebre, se interrumpirá el tratamiento con Hidratan. Los pacientes deben ser informados de que deben consultar a un médico en el caso de que esta situación ocurra. Puesto que el tratamiento de la diarrea con racecadotrilo es sólo sintomático, cuando sea posible, deberá instaurarse tratamiento causal. Se recomienda su uso en las siguientes situaciones: La presencia de deposiciones con sangre o pus y fiebre puede indicar la presencia de bacterias invasivas causantes de la diarrea, o la existencia de otra enfermedad grave. Diarrea causada por antibióticos y diarrea crónica por carecer de estudios o ser insuficientes. La experiencia en pacientes con insuficiencia renal o hepática es limitada. Estos pacientes deben tratarse con precaución (Ver Propiedades Farmacocinéticas). Es posible que la disponibilidad se reduzca en pacientes con vómitos prolongados.
Advertencias: Se puede presentar reacciones en la piel con el uso de este producto. En la mayoría de los casos son moderadas y no requieren tratamiento pero en algunos casos pueden ser graves, incluso potencialmente mortales. No se puede excluir totalmente la asociación con racecadotrilo. En caso de experimentar reacciones graves en la piel, el tratamiento tiene que ser interrumpido de inmediato. Se han comunicado casos de hipersensibilidad/edema angioneurótico en pacientes en tratamiento con racecadotrilo. Éstos pueden aparecer en cualquier momento del tratamiento. El angioedema puede aparecer en cara, extremidades, labios y membranas mucosas. Si el angioedema se asocia con obstrucción de la vía aérea superior, como lengua, glotis y/o laringe, deberá administrarse rápidamente un tratamiento de urgencia. Racecadotrilo deberá discontinuarse y el paciente deberá ser sometido a una continua y estrecha monitorización hasta la completa y sostenida resolución de los síntomas. Los pacientes con antecedentes previos de angioedema no relacionados con el tratamiento con racecadotrilo pueden tener un mayor riesgo de angioedema. El uso concomitante de racecadotrilo e inhibidores de la ECA puede incrementar el riesgo de angioedema (ver Interacciones con Alimentos y Medicamentos). Por tanto, es necesario realizar una cuidadosa evaluación del riesgo-beneficio antes de iniciar un tratamiento con racecadotrilo en pacientes tratados con inhibidores de la ECA.
Las reacciones adversas enumeradas a continuación han ocurrido con mayor frecuencia con racecadotrilo. La frecuencia de las reacciones adversas se define usando la siguiente convención: muy frecuente ($\geq 1/10$), frecuente ($\geq 1/100$ a $< 1/10$), poco frecuente ($\geq 1/1.000$ a $< 1/100$), rara ($\geq 1/10.000$ a $< 1/1.000$), muy rara ($< 1/10.000$), frecuencia desconocida (no puede estimarse a partir de los datos disponibles).Trastornos del sistema nerviosoFrecuente: Cefalea.Trastornos de la piel y del tejido subcutáneo (ver Precauciones y Advertencias)Poco frecuentes: Erupción, eritema.Frecuencia desconocida:Eritema multiforme, edema de lengua, edema de cara, edema de labios, edema de párpados, angioedema, urticaria, eritema nodoso, erupción popular, prurigo, prurito y reacción tóxica de la piel.Notificación de sospechas de reacciones adversasEs importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema de Farmacovigilancia: farmacovigilancia@quimfa.com.py
El uso concomitante de racecadotrilo con inhibidores de la ECA (por ejemplo, captopril, enalapril, lisinopril, perindopril, ramipril) puede aumentar el riesgo de angioedema (ver Precauciones y Advertencias). Hasta el momento, no se han descrito interacciones con otros medicamentos en humanos. En humanos, el tratamiento concomitante con Racecadotrilo y Loperamida o nifuroxazida no modifica la cinética del Racecadotrilo.
No se han descrito casos de sobredosis.Se han administrado dosis superiores a $2 \text{ g}$ en una sola toma, el equivalente a 20 veces la dosis terapéutica, sin que se hayan observado efectos nocivos. No se han descrito casos de sobredosis.En caso de sobredosis o ingesta accidental, consultar al SERVICIO DE TOXICOLOGÍA DEL HOSPITAL DE EMERGENCIAS MÉDICAS Tel: 220-418 o el 204-800 (int. 011).
Embarazo No existen datos suficientes sobre la utilización de Racecadotrilo en mujeres embarazadas. Sin embargo, en ausencia de estudios clínicos específicos, Racecadotrilo no debe administrarse a mujeres embarazadas. Lactancia Debido a la falta de datos sobre la excreción de Racecadotrilo a la leche materna, este medicamento no debe administrarse a mujeres durante el período de lactancia. Fertilidad: no se dispone de datos en humanos. Efectos sobre la capacidad para conducir y utilizar máquinas La influencia de Racecadotrilo sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Productos comprados con frecuencia
Consultas de productos (0)
Iniciar sesión O RegistroPara enviar sus preguntas al vendedor
Otras preguntas
No, nadie se ha preguntado al vendedor todavía
Productos más vendidos